Лечение острой респираторной инфекции у взрослых: результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического. Рандомизация в клинических испытаниях Рандомизированные контролируемые двойные слепые исследования
Противоопухолевых препаратов различаются, каждое из них проводится для конкретно поставленных целей и подбирается под необходимые параметры для исследования препарата. На настоящий момент выделяют следующие виды клинических исследований:
Открытое и слепое клиническое исследование
Клиническое исследование может быть открытым и слепым. Открытое исследование - это когда и врач, и его пациент знают, какой препарат исследуется. Слепое исследование делится на простое слепое, двойное слепое исследование и полное слепое исследование.
- Простое слепое исследование - это когда одна сторона не знает, какой препарат исследуется.
- Двойное слепое исследование и полное слепое исследование - это когда две или более стороны не обладают информацией относительно исследуемого препарата.
Пилотное клиническое исследование проводится для получения предварительных данных, важных для планирования дальнейших этапов исследования. На простом языке можно было бы назвать его «пристрелочным». С помощью пилотного исследования определяется возможность проведения исследования на большем числе испытуемых, рассчитываются необходимые мощности и финансовые затраты для будущего исследования.
Контролируемое клиническое исследование - это сравнительное исследование, в котором новый (исследуемый) препарат, эффективность и безопасность которого еще до конца не изучены, сравнивают со стандартным способом лечения, то есть препаратом, уже прошедшим исследования и вышедшим на рынок.
Пациенты в первой группе получают терапию исследуемым препаратом, пациенты во второй – стандартным (эта группа называется контрольной , отсюда название вида исследования). Препаратом сравнения может быть как стандартная терапия, так и плацебо.
Неконтролируемое клиническое исследование - это исследование, в котором нет группы испытуемых, принимающих препарат сравнения. Обычно такой вид клинических исследований проводится для препаратов с уже доказанной эффективностью и безопасностью.
Рандомизированное клиническое исследование - это исследование, в котором пациенты распределяются на несколько групп (по видам лечения или схеме приема препарата) случайным образом и имеют одинаковую возможность получить исследуемый или контрольный препарат (препарат сравнения или плацебо). В нерандомизированном исследовании процедура рандомизации не проводится, соответственно пациенты не разделяются по отдельным группам.
Параллельные и перекрестные клинические исследования
Параллельные клинические исследования - это исследования, при которых испытуемые в различных группах получают либо только изучаемое лекарственное средство, либо только препарат сравнения. В параллельном исследовании сравниваются несколько групп испытуемых, одна из которых получает исследуемый препарат, а другая группа является контрольной. В некоторых параллельных исследованиях сравнивают различные виды лечения, без включения контрольной группы.
Перерекрестные клинические исследования – это исследования, в которых каждый пациент получает оба сравниваемых препарата, в случайной последовательности.
Проспективное и ретроспективное клиническое исследование
Проспективное клиническое исследование – это наблюдение за группой больных в течение длительного времени, до наступления исхода (клинически значимого события, которое служит объектом интереса исследователя – ремиссия, ответ на лечение, возникновение рецидива, летальный исход). Такое исследование является самым достоверным и поэтому проводится чаще всего, причем в разных странах одновременно, другими словами, оно является интернациональным.
В отличие от проспективного исследования, в ретроспективном клиническом исследовании , напротив, изучаются исходы проведенных ранее клинических исследований, т.е. исходы наступают до того, как началось исследование.
Одноцентровое и многоцентровое клиническое исследование
Если клиническое исследование проходит на базе одного исследовательского центра, оно называется одноцентровым , а если на базе нескольких, то многоцентровым . Если же, исследование проводится в нескольких странах (как правило, центры расположены в разных странах), его называют международным .
Когортное клиническое исследование – это исследование, в котором выделенную группу (когорту) участников наблюдают в течение какого-то времени. По окончании этого времени результаты исследования сравниваются у испытуемых в разных подгруппах данной когорты. На основании этих результатов делается вывод.
В проспективном когортном клиническом исследовании группы испытуемых составляют в настоящем времени, а наблюдают в будущем. В ретроспективном когортном клиническом исследовании группы испытуемых подбирают на основании архивных данных и прослеживают их результаты по настоящее время.

Какой вид клинического исследования будет наиболее достоверным?
В последнее время, фармацевтические фирмы обязывают проводить клинические исследования, при которых получаются самые достоверные данные . Чаще всего удовлетворяет таким требованиям проспективное двойное слепое рандомизированное многоцентровое плацебо-контролируемое исследование . Это значит, что:
- Проспективное – будет вестись наблюдение в течение длительного времени;
- Рандомизированное – пациентов случайно распределили по группам (обычно это делает специальная компьютерная программа, чтобы в итоге различия между группами стали несущественными, то есть статистически недостоверными);
- Двойное слепое - ни врач, ни пациент не знает, в какую группу пациент попал при рандомизации, поэтому такое исследование максимально объективно;
- Многоцентровое – выполняется сразу в нескольких учреждениях. Некоторые виды опухолей чрезвычайно редки (например, наличие ALK-мутации при немелкоклеточном раке легкого), поэтому в одном центре сложно найти необходимое количество пациентов, соответствующих критериям включения в протокол. Поэтому такие клинические исследования проводятся сразу в нескольких исследовательских центрах, причем как правило, в нескольких странах одновременно и называются международными;
- Плацебо-контролируемое – участники делятся на две группы, одни получают исследуемый препарат, другие – плацебо;
Рандомизированные контролируемые клинические испытания (РКИ), проводятся в стационарах, реже в других ЛПУ с целью оценки потенциальной эффективности средств, способов и схем лечения, диагностики, болезней.
При оценке потенциальной эффективности препарата, предлагаемого для лечения какой либо болезни, популяцией являются больные с одинаковым клиническим течением этой болезни, сравнительно одинакового пола и возраста и другими признаками, которые могут влиять на исход болезни.
Выборка формируется с учетом определенных ограничений, при этом больные, представляющие популяцию, не попадают в выборку в основном по следующим причинам:
не соответствие критериям отбора по факторам, которые могут повлиять на предполагаемый эффект экспериментального лечения;
отказ участвовать в эксперименте;
предполагаемая возможность несоблюдения отдельными лицами условий эксперимента (например, нерегулярный прием назначенного препарата, нарушение правил обращаемости и т.д.);
противопоказания к экспериментальному лечению.
В результате такого отбора сформированная выборка может оказаться малочисленной, что скажется на результатах оценки достоверности различий частоты исходов в опытной и контрольной группе. Кроме того, сформированная выборка может быть резко смещена и даже достоверные данные будут иметь существенные ограничения при распространении результатов на всю популяцию больных.
Рандомизация в РКИ должна обеспечить сопоставимость групп по различным признакам и, главное, по признакам, влияющим на исход болезни . Однако этого можно достичь только при достаточно больших выборках, сформировать которые не всегда возможно. При малом числе больных, сопоставимость групп, как правило, нарушается в результате того, что часть лиц, по различным причинам, выбывает из эксперимента, что может препятствовать получению достоверных выводов.
Рис. 7. Рандомизированное контролируемое испытание для оценки результатов ранней выписки из больницы пациентов перенесших инфаркт миокарда.Источник. Основы эпидемиологии. Р Биглхол с соавт. ВОЗ, Женева, 1994.
Приведенные данные (рис. 7) показывают, как по разным причинам резко сократилось число пациентов участвующих в эксперименте. В итоге результаты статистической обработки оказались не достоверны, и по данным этого исследования только весьма ориентировочно можно полагать, что ранняя выписка (через 3 дня) безопасна для лиц перенесших инфаркт миокарда.
По снижению надежности методы рандомизации, применяемые в РКИ, чаще всего распределяют в следующем порядке:
централизованная рандомизация по телефону независимым специалистом статистиком, или представителем фармацевтической фирмы.
метод закодированных (пронумерованных) одинаковых контейнеров, поставляемых фармацевтической фирмой, при этом код и содержание контейнеров неизвестны ни больным, ни врачам, участвующим в исследовании;
централизованный компьютерный метод - компьютерная программа генерирует случайную последовательность распределения пациентов по группам, подобную последовательности в таблице случайных чисел, при этом разделение больных на группы сравнения проводится специалистом, участвующим только в процессе рандомизации.
метод непрозрачных, запечатанных и пронумерованных конвертов. Указания о необходимом вмешательстве помещаются в конверты, последовательно пронумерованные согласно таблице случайных чисел. Крайне важно, чтобы конверты вскрывали только после того, как в приемном отделении исследователь запишет на них фамилию больного и другие необходимые данные;
Независимо от метода, рандомизация может быть простой и стратифицированной (существуют и другие, реже используемые виды рандомизации). В случае простой рандомизации дополнительные факторы не учитываются, а каждый пациент имеет шанс 50 на 50 попасть в ту или иную группу. Стратифицированная рандомизация (выделение подгрупп – страт), применяется в случаях, когда невозможно создать группы с одинаковым прогнозом исхода опыта у испытуемых лиц. Например, если на результат исследования может повлиять один из заданных параметров (возраст, уровень артериального давления, перенесенный инфаркт миокарда и др.) пациентов вначале делят на подгруппы. Далее в каждой подгруппе группе проводят рандомизацию. Некоторые специалисты считают стратифицированную рандомизацию недостаточно корректной.
Несмотря на исключительную важность информации о методе рандомизации для оценки читателем надежности результатов исследования, разные авторы приводят практически одинаковые оценки исследований по этому параметру. Установлено, что в 80 - 90-х годах только в 25 - 35% отчетов об РКИ, опубликованных в специализированных журналах, и в 40 - 50% отчетов, опубликованных в общемедицинских журналах, сообщалось о применении правильного метода генерации случайной последовательности включения участников в группы. Почти во всех этих случаях использовались либо компьютерный генератор, либо таблица случайных чисел. При анализе статей, опубликованных в одном из журналов по дерматологии за 22 года, было установлено, что о применении правильного метода генерации случайной последовательности сообщалось лишь в 1 из 68 отчетов об РКИ.
Важнейший элемент организации РКИ средств лечения - использование метода ослепления (маскирования). Как указывалось в предыдущем разделе, предпочтение отдается двойному и даже тройному слепому исследованию, поскольку больные или медицинский персонал, участвующий в испытании, невольно или преднамеренно, могут исказить данные и повлиять тем самым на результат исследования.
Маскирование вмешательств от больных важно, потому что исход применяемого воздействия в значительной степени зависит от психологического состояния пациента. При открытости информации больные опытной группы могут либо неоправданно надеяться на благоприятный исход лечения, либо наоборот переживать по поводу того, что согласились быть «подопытными кроликами». Больные контрольной группы также могут вести себя по-разному, например, чувствовать себя обделенными, особенно если они будут считать, что в опытной группе процесс лечения более успешен. Разное психологическое состояние больных может привести к целеноправленным поискам ими признаков улучшения или наоборот ухудшения состояния их здоровья, что неминуемо скажется на собственной оценке состояния, изменения которого нередко оказываются мнимыми. Маскирование от врача-исследователя необходимо, так как он может быть заведомо убежден в преимуществах испытуемого средства и субъективно трактовать изменения состояния здоровья испытуемых.
Необходимость двойного маскирования объективно подтверждает «эффект плацебо». Плацебо – лекарственная форма, неотличимая от исследуемого препарата по внешнему виду, цвету, вкусу и запаху, но не оказывающая специфического действия, или иное безразличное вмешательство, используемое в медицинских исследованиях для имитации лечения с целью устранения систематической ошибки, связанной с плацебо-эффектом. Плацебо-эффект – изменение состояния пациента (отмечаемое самим пациентом или лечащим врачом), связанное только с фактом лечения, а не с биологическим действием препарата.
Многочисленными исследованиями установлено, что некоторые больные (в зависимости от болезни до 1/3) принимая плацебо за лекарство, реагируют на него так же, или почти так же, как и больные опытной группы. Изучение эффекта плацебо позволяет выделить специфические составляющие нового лечения. Кроме того, если больные не знают, к какой группе они относятся, они более точно следуют правилам эксперимента.
Как упоминалась в предыдущем разделе, для повышения надежности выводов вводят третье ослепление на этапе статистической обработки данных, поручая эти действия независимым лицам.
«Слепые» клинические исследования не используются при оценке потенциальной эффективности хирургических вмешательств, методов физиотерапии, диет, многих диагностических процедур и т.д., т.е. в тех случаях, когда замаскировать воздействие невозможно, или нецелесообразно ни для больных, ни для врачей. В таких случаях рандомизированные исследования называют открытыми.
По истечении установленного времени наблюдения проводят статистическую обработку выявленных исходов (эффектов воздействия) болезни в опытной и контрольной группе. Для того чтобы избежать систематическую ошибку, критерии исхода болезни в опытной и контрольной группах больных должны быть специфичны и одинаковы. Для повышения надежности выводов исследование нередко проводят не одномоментно, а в течение некоторого периода, включая в него вновь поступающих больных.
Для статистической обработки полученных данных применяется все та же таблица «два на два».

Таблица 11. Макет таблицы «два на два» для оценки результатов экспериментальных исследований.
Большинство показателей, оценивающих эффективность экспериментального воздействия в клинических и полевых испытаниях, хотя и имеют другие названия (так исторически сложилось), соответствуют и по способу расчета и по смыслу величинам, рассчитываемым в когортных исследованиях.
Для количественного выражения эффективности используют различные статистические показатели, при этом отсутствует строгая унификация их названий.
1.
Показатель
относительной эффективности (
показатель
эффективности
):

Эта величина соответствует относительному риску, вычисляемому в когортных исследованиях . Показатель эффективности определяет во сколько раз , частота позитивных исходов воздействия в опытной группе выше, чем их частота в контрольной группе, т.е. во сколько раз новый способ лечения, диагностики и др., лучше, чем обычно используемый.
Для интерпретации показателя эффективности используются оценочные критерии относительного риска (см. статистическую обработку данных когортного исследования). При этом, соответственно, изменяется смысл формулировок, так как оценивается не фактор риска болезни, а эффективность применяемого экспериментального воздействия.
2. Атрибутивный (добавочный) эффект , соответствует атрибутивному (добавочному) риску, определяемому в когортных исследованиях.

Величина атрибутивного эффекта показывает на сколько эффект от экспериментального воздействия больше, чем эффект от воздействия в контрольной группе;
3 . Доля эффекта воздействия (доля эффективности ) соответствует этиологической доле вычисляемой при анализе данных когортных исследований.

Эта величина показывает долю позитивных исходов, принадлежащую экспериментальному воздействию, в сумме позитивных эффектов в опытной группе.
4. дополнительная величина, которую назвали - число больных, которых необходимо лечить (ЧБНЛ) для предотвращения одного неблагоприятного исхода.

Чем больше этот показатель, тем меньше потенциальная эффективность изучаемого воздействия.
Так же, как и при обработке данных когортных исследований, достоверность полученных данных в экспериментах оценивается с помощью критерия «хи-квадрат» или другими методами.
В заключение отметим, что, несмотря на все достоинства, рандомизированные клинические испытания таят в себе возможность систематической ошибки, особенно ошибки связанной с формированием выборки. Следовательно, результаты одного исследования, даже безупречного по организации, не могут рассматриваться как безусловная рекомендация применения нового препарата в клинической практике. Именно поэтому в настоящее время надежными считаются только результаты многоцентровых исследованиий эффективности одного и того же вмешательства (лечения) несколькими клиниками, при этом желательно, чтобы исследования проводились в клиниках разных странах.
КАКИЕ ВИДЫ РАНДОМИЗИРОВАННЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ СУЩЕСТВУЮТ? ПРЕИМУЩЕСТВА И НЕДОСТАТКИ РАНДОМИЗИРОВАННЫХ КЛИНИЧЕСКИХ ИССЛДЕОВАНИЙ
Рандомизированные исследования могут быть открытыми и “слепыми” (маскированными). Открытым рандомизированное испытание считается в том случае, если и пациент, и врач сразу после проведения рандомизации узнают о том, какой вид лечения будет применен у данного больного. На практических занятиях студенты легко и быстро запоминают дизайн «слепого» исследования. При слепом исследовании больному не сообщается о виде применяемого лечения, и этот момент обговаривается с пациентом заранее при получении информированного согласия на исследование. Врач узнает, какой вариант лечения получит больной, после процедуры рандомизации. При выполнении двойного слепого исследования ни врач, ни пациент не знают, какое из вмешательств применяется у конкретного пациента. В тройном слепом исследовании о типе вмешательства не знают больной, врач и исследователь (статистик), обрабатывающий результаты исследования. В настоящее время в мировой практике “золотым стандартом” считаются рандомизированные контролируемые (проспективные) испытания с двойным или тройным “слепым” контролем.
Исследования могут быть одноцентровыми или многоцентровыми. При проведении многоцентровых РКИ в испытания участвует несколько учреждений, что обеспечивает формирование однородной по всем прогностическим признакам большой выборки за короткий срок.
Преимущества и недостатки рандомизированных контролируемых исследований
Преимущества:
- · Результаты исследований не зависят от мнения исследователей, систематическая ошибка не оказывает большого влияния. обеспечивает отсутствие различий между группами.
- · Наиболее убедительный способ проведения
- · Контролируют известные и неизвестные искажающие факторы
- · Возможность проведения в последующем мета-анализа
Недостатки:
- · Высокая стоимость.
- · Методика выполнения сложна, сложность отбора пациентов (обычно в исследования, какими бы крупными они не были, можно включить только 4-8% больных из всей популяции с данным заболеванием), что приводит к снижению обобщаемости результатов на популяцию, т.е. доказанные в исследовании результаты можно распространять только на больных, идентичных включенным в рандомизированные исследования.
- · Этические проблемы.
На 6-м курсе на одной из кафедр преподаватель задал вопрос нашей группе: «По какому принципу лекарства рекомендуют для лечения той или иной болезни? ». Некоторые студенты предположили, что лекарства выбирают на основании механизма их действия, особенностей болезни и т.д. Это не совсем точные ответы. В наши дни лекарственные препараты выбирают в первую очередь по их эффективности . И делают это с помощью строгих научных методов . Сегодня вы узнаете:
- какое исследование дешевле - продольное или поперечное,
- что пустышки нравятся не только детям,
- почему лечение вслепую считается наиболее ценным.
Современные методы лечения основываются на позициях доказательной медицины (evidence based medicine ). «Медицину, основанную на доказательствах », также называют «клинической эпидемиологией ». Доказательная медицина позволяет прогнозировать течение заболевания у конкретного больного на основании протекания многих аналогичных случаев, изученных с помощью строгих научных методов математической статистики.
Чтобы сделать какие-то выводы об эффективности или неэффективности лекарства, проводят исследования. Прежде чем лекарственный препарат попадет на проверку реальным пациентам, он проходит целый ряд опытов на живых тканях, животных и здоровых добровольцах. Более подробно об этих стадиях я расскажу отдельно в материале «Как разрабатывают лекарства». В конце эффективность и безопасность препарата проверяют на группе больных людей, такое испытание называется клиническим .
При подготовке клинического исследования ученые определяют контингент обследуемых, критерии отбора и исключения, методику анализа изучаемого явления и многое другое. Все это в совокупности называется дизайном исследования .
Виды клинических исследований
Существует 3 типа клинических исследований , имеющих свои преимущества и недостатки:
- поперечные (одномоментные) исследования,
- продольные (проспективные, лонгитудинальные, когортные) исследования,
- ретроспективные исследования («случай - контроль»).
Теперь подробнее о каждом типе.
1) Поперечное (одномоментное) исследование .
Это однократное обследование группы пациентов . Можно получить, например, статистику заболеваемости и текущего протекания болезни в изучаемой группе. Напоминает фотографию, сделанную в определенный момент времени. Поперечное исследование стоит дешево, но по нему невозможно понять динамику болезни.
Пример: профилактический осмотр цехового врача на предприятии.
2) Продольное (проспективное, лонгитудинальное, когортное) исследование .
Терминология: от лат. longitudinalis - продольный.
Продольное исследование - это наблюдение за группой больных в течение длительного времени . На сегодняшний день такие исследования являются самими достоверными (доказательными) и поэтому проводятся чаще всего. Однако стоят они дорого и чаще всего выполняются в нескольких странах одновременно (т.е. являются интернациональными).
Почему продольные иследования называют также когортными? Когорта -
- Тактическое подразделение легиона в Древнем Риме (со 2 века до н. э.). В легионе было 10 когорт, в когорте - 360-600 человек.
- В переносном смысле - крепко сплочённая группа людей.
- В клинической эпидемиологии когорта - это группа лиц, изначально объединенных каким-либо общим признаком (например: здоровые лица или больные на определенной стадии заболевания) и наблюдаемых в течение определенного периода времени.
Схема модели исследования в одной группе .
Среди проспективных исследований выделяют простые и двойные слепые, открытые и др., об этом подробнее - чуть ниже.
3) Ретроспективные исследования («случай - контроль») .
Эти исследования проводятся, когда надо связать факторы риска из прошлого с теперешним состоянием больного. Простейший пример: у больного случился инфаркт миокарда , участковый врач листает его карточку и думает: «Действительно, высокий холестерин в течение нескольких лет ничем хорошим не заканчивается. Надо будет чаще назначать больным статины ».
Ретроспективные исследования дешевы, но обладают низкой доказательностью, т.к. сведения из прошлого не являются надежными (например, амбулаторную карточку могли заполнять задним числом или без осмотра больного).
Двойное слепое рандомизированное многоцентровое плацебо-контролируемое исследование
Как я упоминал выше, наиболее доказательными являются проспективные (продольные) исследования , именно поэтому они проводятся чаще всего. Наиболее достоверным на сегодняшний день из всех проспективных исследований является двойно?е слепо?е рандомизи?рованное многоцентрово?е плаце?бо-контроли?руемое испыта?ние . Название выглядит слишком научно, но ничего сложного в нем нет. Объясню термин по словам.
Что такое рандомизированное исследование ? Слово произошло от англ. randomize - располагать в случайном порядке; перемешивать. Поскольку эффективность проверяемого препарата нужно с чем-то сравнивать, в каждом исследовании есть опытная группа (в ней проверяют необходимый препарат) и контрольная группа , или группа сравнения (пациентам из контрольной группы проверяемый препарат не дают). Забегая вперед, скажу, что исследование с контрольной группой называется контролируемым .
Рандомизация в данном случае - это СЛУЧАЙНОЕ распределение пациентов по группам. Крайне важно, чтобы исследователи в своих корыстных целях не могли собрать более легких больных в опытную группу, а более тяжелых - в контрольную. Существуют специальные методы рандомизации, чтобы в итоге различия между группами стали статистически недостоверными. О понятии «достоверность » в доказательной медицине я тоже расскажу дальше.
Что такое слепое и двойное слепое исследование ? При одиночном слепом исследовании больной не знает, в какую группу он попал при рандомизации и какой препарат ему дают, но это знает медработник, который может непроизвольно или случайно выдать тайну. При двойном слепом исследовании ни врач, ни пациент не в курсе, что именно получает конкретный больной, поэтому такое исследование более объективно.
Примечание. Если по каким-то причинам использовать плацебо не получается (например, врач или больной легко могут узнать лекарство по его эффектам, например: MgSO4 при внутривенном введении дает непродолжительное ощущение сильного жара изнутри), проводят открытое исследование (и врач, и больной знают о том, какой именно препарат назначен). Однако открытое исследование намного менее достоверно.
Любопытно, что из общего числа больных в стационаре плацебо (лекарство-пустышка; плацебо имитирует лекарственный препарат, но активного вещества не содержит) помогает 25-35% , в случаях психических заболеваний - до 40%. Если прием плацебо у пациента имеет ярко выраженный положительный эффект, такие пациенты могут исключаться из исследования.
Вместо плацебо может применяться препарат, который хотят сравнить с проверяемым. В свою очередь, проверяемый препарат может приниматься в одном из 2 вариантов:
- в параллельных группах : т.е. в одной группе принимают изучаемый препарат, а во второй (контрольной) - плацебо или препарат сравнения.
Схема модели исследования в параллельных группах .
- в перекрестном исследовании : каждый пациент в определенной последовательности получает испытуемый и контрольный препарат. Между приемом этих препаратов должен быть свободный период, призванный «ликвидировать» последствия приема предыдущего препарата. Такой период называется «ликвидационным », или «отмывочным ».
Схема «перекрестной» модели исследования .
Что такое контролируемое исследование ? Как я упоминал чуть выше, это исследование, в котором имеется 2 группы больных: опытная группа (получающая новое лекарство или новый метод лечения) и контрольная группа (НЕ получающая его). Однако есть небольшая проблема. Если не давать лекарственный препарат больным из контрольной группы, они решат, что их не лечат, а потом обидятся и впадут в депрессию. Результаты лечения однозначно будут хуже. Поэтому исследователи дают контрольной группе плацебо - пустышку.
Виды контроля в доказательной медицине:
- По внешнему виду и вкусу плацебо благодаря специальным наполнителям без активного вещества напоминает проверяемый лекарственный препарат. Этот вид контроля называется плацебо-контролем (негативным контролем) .
- Если же пациенту, принимающему плацебо, может быть нанесен существенный вред из-за отсутствия лечения, то плацебо заменяют на эффективный препарат сравнения. Такой вид контроля называется активным (позитивным) . Активный контроль используется также в рекламных целях, чтобы показать, что новый препарат превосходит по эффективности уже имеющиеся.
- исторический контроль
, или контроль по архивной статистике
. Используется, когда эффективных методов лечения заболевания не существует, и сравнивать просто не с чем. В этом случае результаты лечения сравниваются с обычной выживаемостью таких больных.
Примеры: некоторые виды лечения рака, операции по пересадке органов на ранних этапах развития трансплантологии.
- контроль исходного состояния . Пациентов обследуют, а результаты лечения сравнивают с исходным состоянием до экспериментального лечения.
Для полноты изложения упомяну и два более редких способа контроля:
Многоцентровым называют исследование, которое выполняется сразу в нескольких «центрах» - клиниках. Некоторые болезни довольно редки (к примеру, отдельные виды рака), и в конкретный момент времени в одном центре сложно найти нужное число пациентов-добровольцев, подходящих под критерии включения в исследование. Обычно такие исследования стоят дорого и проводятся в нескольких странах, являясь международными. Например, многие больницы Минска тоже принимали в них участие.
Контрольный период
В каждом исследовании должен быть контрольный (вводный) период , в течение которого пациент не получает испытуемое лекарство или препарат схожего типа действия, за исключением жизненно необходимых (например, нитроглицерин при стенокардии). В международных испытаниях в этот период обычно назначается плацебо .
Исследование без контрольного периода и рандомизации (случайного распределения по группам) не может считаться контролируемым, поэтому его результаты сомнительны.
В каждом исследовании должны быть четко изложены критерии включения и исключения пациентов из исследования. Чем лучше они продуманы, тем достовернее получатся результаты. Например, исследуя эффективность?-блокаторов как антиишемических препаратов, мы должны исключать из исследования пациентов, принимающих другие препараты со сходным действием: нитраты и(или) триметазидин.
Недостатки контролируемых рандомизированных исследований
1) Нерепрезентативность отобранной группы , т.е. неспособность данной выборки правильно отражать свойства всей популяции. Другими словами, по этой группе пациентов нельзя делать правдивые выводы о всех больных с данной патологией.
Как я указывал чуть выше, существуют строгие критерии включения и исключения пациентов из исследования. Это нужно для получения однородности групп пациентов, которые можно будет сравнивать. Обычно это не самые тяжелые больные, т.к. у тяжелобольных нельзя выполнить строгие требования контролируемых исследований: наличие контрольного периода, прием плацебо, тесты с нагрузкой и т.д.
Например, в исследовании RITA (1993 год) сравнивали результаты чрескожной транслюминальной коронарной ангиопластики (расширение суженной артерии с помощью раздувания мини-баллона в ее просвете) с аортокоронарным шунтированием (создание обходного пути для тока крови мимо суженного участка артерии). Из-за того, что в исследование было включено лишь 3% больных из числа подвергнутых коронарной ангиографии, его результаты нельзя распространять на оставшиеся 97% пациентов. Выборка нерепрезентативна.
2) Конфликт интересов .
Когда фирма-производитель вкладывает огромные деньги в клинические испытания своего препарата (т.е. фактически оплачивает работу исследователей), с трудом верится, что автор не приложит максимум усилий для получения положительного результата.
По этим причинам результаты единичных исследований не могут считать абсолютно надежными .
4
1 ГБОУ ВПО «Ивановский государственный университет»
2 ФГАОУ ВПО «Московский физико-технический институт (государственный университет)" г. Долго- прудный Московской области
3 ГБОУ ВПО «Ивановская ГМА» МЗ РФ
4 ФГБОУ ВО «Ивановская государственная медицинская академия» МЗ РФ
Для цитирования:
Егорова Е.Ю., Юргель И.С., Назаренко О.А., Философова М.С., Альпер И.А., Торшин И.Ю., Юдина Н.В., Гришина Т.Р., Громова О.А. Рандомизированное контролируемое исследование эффективности препарата Прогепар у пациентов с хроническим алкогольным гепатитом // РМЖ. 2011. №12. С. 753
Введение Гепатопротекторы различаются по механизмам и спектру своего фармакологического воздействия. В 2008 году, в России в группе гепатопротекторных средств (КодАТХ: А05ВА) зарегистрирован препарат «Прогепар». В Германии и Японии этот препарат известен, как «Proheparum S.» От ранее известного препарата «Prohepar» отличается наличием особых синергидных компонентов (что и обозначает литера «S» в названии препарата).
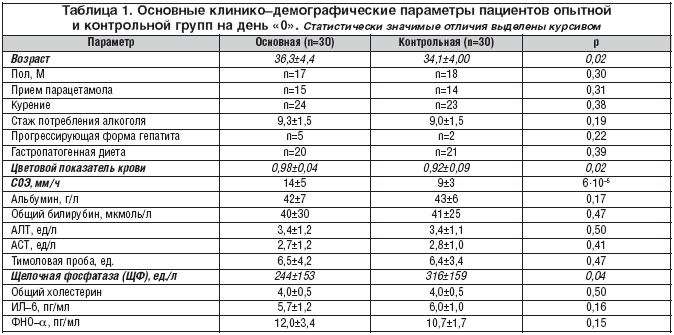







Литература
1. Громова О.А., Торшин И.Ю., Юргель И.С. с соавт. Механизмы действия и клиническая эффективность комбинированного гепатопротекторного препарата Прогепар. Трудный Пациент, 2009, №12.
2. Баяши А.О., Акиома Х., Тацаки Х. Воздействие гидролизата печени на циркуляцию крови при хронических заболеваниях печени //Арцнаймиттель Форшунг, - 1972, 22С.578-580.
3. Fujisawa K., Suzuki H., Yamamoto S., Hirayama C., Shikata T., Sanbe R. Therapeutic effects of liver hydrolyzate Prohepar in chronic hepatitis - A double-blind controlled study. Asian Med. J. 26(8):497-526
4. Демидов В.И., Назаренко О.А., Егорова Е.Ю. с соавт. Исследование эффективности Прогепара при экспериментальном повреждении печени алкоголем и парацетамолом: биохимия и гистология. Фарматека, 2011, № 2.
5. Егорова Е.Ю., Философова М.С., Торшин И.Ю. с соавт. Сравнительная динамика персистирующей и прогрессирующей форм алкогольного гепатита в курсе терапии препаратом Прогепар. Российский Медицинский Журнал, Российский Медицинский Журнал, Том 19, № 2, 2011.
6. Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» www.government.ru .
7. Ивашкин В.Т., Маевская М.В. Алкогольно-вирусные заболевания печени. - М.: Литтерра, 2007. - 160 с.
8. Громова О. А., Сатарина Т. Е., Калачева А. Г., Лиманова О. А. Структурированный вопросник по оценке дефицита витаминов. Рационализаторское предложение № 2461 от 17 ноября 2008 г.
9. Журавлев Ю. И. Избранные научные труды. - М.: Магистр, 1998. - 420 с.
10. Журавлев Ю.И. Об алгебраическом подходе к решению задач распознавания или классификации//Проблемы кибернетики: Вып.33.. - 1978. - с. 5-68.
11. Тогузов Р.Т., Шачнев Е.А., Назаренко О.А. с соавт. Содержание фолатов и липоевой кислоты в гепатопротекторе прогепар, Фарматека, 2011, 3
12. Ребров В.Г., Громова О.А. Витамины, макро- и микроэлементы. ГэотарМед, М., - 2008, 946 с.
13. Торшин И.Ю., Громова О.А. Физиологическая модель взаимосвязи витамина D3 с онкологическими заболеваниями и данные доказательной медицины, Трудный пациент, 2008, №11, С. 21-26
14. Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M, Yagi K. Hepatoprotective effect of vitamin B12 on dimethylnitrosamine-induced liver injury. Biol Pharm Bull. 2008 Feb;31(2):309-11.
